Perczel András kutatócsoportja univerzális jelentőségű fehérje térszerkezetét határozta meg krio-eletronmikroszkóppal. Felfedezték, hogy egy hasznosnak tűnő antibiotikum is képes az emberi szervezetben létfontosságú fehérjéket blokkolni. Tanulmányuk a Chemical Science címlapjára került.
Ha részleteiben meg akarjuk érteni, hogyan működnek a fehérjék és más makromolekulák szöveteinkben és sejtjeinkben, akkor fel kell térképeznünk térszerkezetüket és kölcsönhatásukat. Az atomi szintű hálózat vizsgálatára a krio-elektronmikroszkópia nemrégiben vált alkalmassá, és széles körben is rendkívül hatékonynak bizonyult. A speciális mikroszkóppal a fehérjemolekulákat -137°C alatti hőmérsékleten vizsgálják, ahol felderíthetővé válnak a belső mozgások és a kölcsönhatások is.
A vitrifikálás (gyors lefagyasztás) megőrzi és rögzíti a makromolekulák természetes téralkatát,
ideális esetben sokféle orientációban, úgy, ahogy a molekulák éppen az oldatban forognak. Az elektronnyaláb kölcsönhatásba lép a vizsgált mintával, a szóródásával létrejövő képeket feldolgozva a molekulára jellemző 3D-alakzatok (2D vetületei) csoportokba rendezhetők. Ezután történik a képalkotás, hasonlóan a makroszkópikus világban alkalmazott 3D-scanneléshez, amelynek során a sokféle irányból készített felvételekből rekonstruálható lesz egy tárgy térbeli alakja.
A 2017-ben Nobel-díjjal elismert krio-EM módszer nagyméretű molekuláris struktúrák, akár vírusok vagy riboszóma, proteaszóma és más fehérje-multimerek és komplexek 3D-szerkezeteinek és molekuláris kölcsönhatásainak feltérképezésére, de akár hatóanyagok tervezésének támogatására alkalmas. A kutatásban új lehetőségeket megnyitó módszert használja az NKFIH Top 50 kutatóhelye között szereplő ELKH-ELTE Fehérjemodellező Kutatócsoport és Szerkezeti Kémiai és Biológiai Laboratórium is a nagyobb fehérjék szerkezetkutatásában.
Az ELTE kutatói korábban meghatározták az AAP (acilaminoacil-peptidáz) enzim-tetramer térszerkezetét, amelynek emlősökben előforduló formája addig ismeretlen volt. Az AAP a szervezet egyik legfontosabb hibajavító rendszerét támogatja, segítve a hibásan feltekeredett és sérült fehérjék lebontását. Az AAP gátlása például az oxidatív stressz hatására károsodott fehérjék felhalmozódásához vezet a szervezetben, ami közismerten malignus átalakulásokhoz vezethet. Az AAP aktív centruma egyedülálló: a katalitikus szerin (Ser587) nagyobb konformációs szabadságot kap, így a klasszikus szerin-proteáz katalitikus triád fellazul, az aktív és az inaktív konformációk között váltakozik. A meropenem kötődésekor az aktív hely átrendeződik, és az AAP többé nem tudja betölteni a katalizátor szerepét.
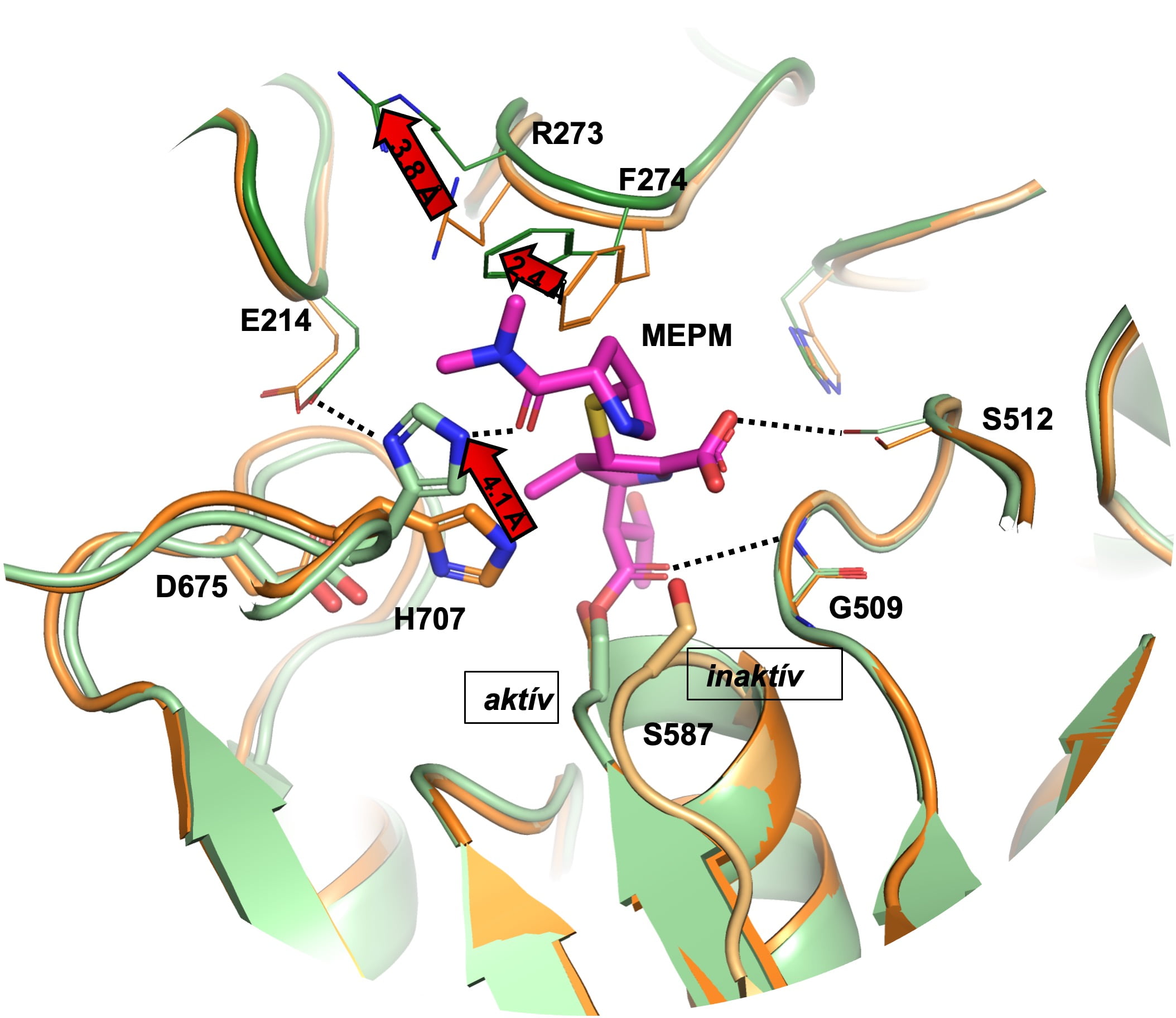
Az ábra azt mutatja, hogy a meropenem nevű antibiotikum molekula hogyan kötődik az AAP fehérjéhez, aminek következtében az AAP nem tudja többé betölteni a katalizátor szerepét.
Perczel András, az ELTE Szerves Kémia Tanszék vezetője és kutatótársai – Kiss-Szemán Anna, Jákli Imre, Harmat Veronika és Karancsiné Menyhárd Dóra – mostani munkájuk során igazolták, hogy egy gyakran használt, penicillinszerű antibiotikum amellett, hogy hatékonyan harcol a baktériumok ellen, gátolja az emberi szervezet AAP proteáz enzimének működését. Az AAP és a meropenem nevű antibiotikummal képzett komplexének szerkezetét vizsgálva világossá vált, hogy az antibiotikum az enzim aktív helyéhez kötődik kovalensen, így irreverzibilisen gátolja azt.
A meghatározott szerkezet az első, amely egy emlős (az emberihez nagyon hasonló) enzim és egy penicillin-származék komplexéről készült.
Az eredmény hozzájárul az AAP működésének jobb megértéséhez, alapját képezheti újfajta terápiás megoldások kidolgozásának, valamint bepillantást enged azokba a mechanizmusokba, amelyek révén az antibiotikumok mellékhatásokat okozhatnak az emberi fiziológiában.
A tanulmány a Chemical Science címlapjára került, „Pick of the Week” megtisztelő címet kapott, és bekerült az újság éves „Hot Article Collection” válogatásába is.
Perczel Andrással a felfedezésről az mta.hu beszélgetett, az interjút itt olvashatja el.
Forrás: ELTE